Vamos a hablaros sobre el experimento realizado por Ernest Rutherford en 1911 que permitió instaurar su modelo atómico.
BIOGRAFÍA
 |
| Ernest Rutherford |
Recibió
el Premio Nobel de Química en 1908 ya que contribuyó al entendimiento de la desintegración radioactiva, identificando la
partícula alfa como un átomo de helio, quizás algo irónico ya que tenía un cierto
desprecio hacia cualquier ciencia que no fuera la física,
atribuyéndose la frase "Toda ciencia o es física o es coleccionar
sellos".
La investigación sobre la dispersión de partículas alfa y la naturaleza de la estructura interna del átomo, que más tarde explicaremos a fondo, fue su contribución más importante a la física.
Tuvo una gran influencia en el desarrollo de la física en los
últimos cien años, y es considerado el padre
de la física nuclear. Falleció en Cambridge el 19 de octubre de 1937 y sus cenizas fueron enterradas en la abadía de Westminster.
EXPERIMENTO DE RUTHERFORD
 En 1911 Rutherford realizó el experimento que contribuyó a refutar la validez del modelo atómico de Thomson, propuesto en 1904, y que consideraba que el átomo era una gran esfera maciza y compacta, en la que los electrones, con carga eléctrica negativa, compensan la carga positiva en la que están embebidos.
En 1911 Rutherford realizó el experimento que contribuyó a refutar la validez del modelo atómico de Thomson, propuesto en 1904, y que consideraba que el átomo era una gran esfera maciza y compacta, en la que los electrones, con carga eléctrica negativa, compensan la carga positiva en la que están embebidos.Esta distribución era sugerida a la luz de los experimentos realizados con gases a baja presión encerrados en los tubos de rayos catódicos y canales.
Los gases eran sometidos a tensiones eléctricas muy altas, donde se detectaba la presencia de electrones libres de carga negativa. Mientras que las partículas positivas se presentaban agrupadas como si fueran el resultado de la extracción de un número determinado de electrones de cada átomo. De esta forma, parecía lógico pensar, que los electrones se encontraban encajados en una masa positiva, a la que compensaban eléctricamente. Otros experimentos de la época sirvieron para determinar la carga y masa de las partículas así detectadas.
Rutherford ideó un procedimiento para comprobar la distribución propuesta de carga y masa, que consistía en lanzar partículas positivas hacia el átomo para determinar la situación de sus carga positivas, por repulsión eléctrica.
Sus anteriores estudios sobre la naturaleza de las radiaciones que emitían de forma natural determinados elementos químicos, como el Uranio, le resultaron de mucha utilidad.
En concreto había determinado que estos elementos químicos irradiaban, entre otras partículas, lo que resultó ser núcleos de helio completamente ionizados, es decir, sin su envoltura correspondiente de electrones. Dichos núcleos están formados por dos protones y dos neutrones, pero al no tener electrones, su carga eléctrica es positiva, mientras que su masa es de 4 u, aproximadamente de 8000 veces la de un electrón. Su capacidad de penetración es pequeña; en la atmósfera pierden rápidamente su energía cinética porque interaccionan fuertemente con otras moléculas debido a su gran masa y carga eléctrica. En general no pueden atravesar espesores de varias hojas de papel.
En concreto había determinado que estos elementos químicos irradiaban, entre otras partículas, lo que resultó ser núcleos de helio completamente ionizados, es decir, sin su envoltura correspondiente de electrones. Dichos núcleos están formados por dos protones y dos neutrones, pero al no tener electrones, su carga eléctrica es positiva, mientras que su masa es de 4 u, aproximadamente de 8000 veces la de un electrón. Su capacidad de penetración es pequeña; en la atmósfera pierden rápidamente su energía cinética porque interaccionan fuertemente con otras moléculas debido a su gran masa y carga eléctrica. En general no pueden atravesar espesores de varias hojas de papel.
Fueron identificadas en los años 1899 y 1900 por el mismo Rutherford. Se les llamó rayos alfa y fueron definidos como los que tienen la menor penetración de objetos ordinarios.
Su idea era lanzar las partículas alfa sobre los átomos y detectar las desviaciones en su trayectoria.
Las partículas alfa (α), se aceleran y se hacen incidir sobre una lámina de oro muy delgada. Se eligieron átomos de oro porque éste es un material maleable en finísimas láminas. De tal forma que se podía conseguir oponer a la trayectoria de las partículas alfa muy pocas filas de átomos. Además la masa del átomo de oro es suficientemente grande como para resistir el choque de una partícula alfa sin retroceder.
Su idea era lanzar las partículas alfa sobre los átomos y detectar las desviaciones en su trayectoria.
Las partículas alfa (α), se aceleran y se hacen incidir sobre una lámina de oro muy delgada. Se eligieron átomos de oro porque éste es un material maleable en finísimas láminas. De tal forma que se podía conseguir oponer a la trayectoria de las partículas alfa muy pocas filas de átomos. Además la masa del átomo de oro es suficientemente grande como para resistir el choque de una partícula alfa sin retroceder.
Tras atravesar la lámina, las partículas alfa chocan contra una pantalla recubierta interiormente de sulfuro de zinc, produciéndose un chispazo. De esta forma era posible observar si las partículas sufrían alguna desviación al atravesar la lámina.
Los resultados del experimento se resumen en:
- La mayor parte de las partículas alfa atraviesan la lámina de oro sin desviarse.
- Una de cada 10000 se desviaba un ángulo mayor de 10º.
- En muy raras ocasiones las partículas alfa rebotaban en la lámina.
Además se abrían varios problemas nuevos que llevarían al descubrimiento de nuevos hechos y teorías al tratar de explicarlos:
- Por un lado se planteó el problema de cómo un conjunto de cargas positivas podían mantenerse unidas en un volumen tan pequeño, hecho que llevó posteriormente a la postulación y descubrimiento de la fuerza nuclear fuerte, que es una de las cuatro interacciones fundamentales.
- Por otro lado existía otra dificultad proveniente de la electrodinámica clásica que predice que una partícula cargada y acelerada, como sería el caso de los electrones orbitando alrededor del núcleo, produciría radiación electromagnética, perdiendo energía y finalmente cayendo sobre el núcleo. Las leyes de Newton, junto con las ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de
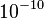 s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo. Se trata, por tanto de un modelo físicamente inestable, desde el punto de vista de la física clásica.
s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo. Se trata, por tanto de un modelo físicamente inestable, desde el punto de vista de la física clásica.
Según Rutherford, las órbitas de los electrones no están muy bien definidas y forman una estructura compleja alrededor del núcleo. Esto le proporciona un tamaño y forma definidas. Los resultados de su experimento le permitieron calcular que el radio atómico era diez mil veces mayor que el del núcleo, y además que el interior del átomo está prácticamente vacío concentrando toda su masa en el núcleo.
MODELOS POSTERIORES
MODELO DE BOHR
 El modelo atómico de Rutherford fue sustituido poco después por el de Bohr (1913). Este intentó explicar que sola algunas órbitas de los electrones son posibles. El modelo de Bohr resolvía el problema, proveniente de la electrodinámica, postulando que sencillamente los electrones no radiaban, hecho que fue explicado por la mecánica cuántica según la cual la aceleración promedio del electrón deslocalizado es nula.
El modelo atómico de Rutherford fue sustituido poco después por el de Bohr (1913). Este intentó explicar que sola algunas órbitas de los electrones son posibles. El modelo de Bohr resolvía el problema, proveniente de la electrodinámica, postulando que sencillamente los electrones no radiaban, hecho que fue explicado por la mecánica cuántica según la cual la aceleración promedio del electrón deslocalizado es nula.- Niels Bohr(1885-1962) propuso un modelo atómico, a partir de los descubrimientos sobre la naturaleza de la luz y la energía.
- Los electrones giran en torno al núcleo en niveles energéticos bien definidos.
- Cada nivel puede contener un número máximo de electrones.
- Cuando un electrón gira en estas órbitas no emite energía
- La conclusión fue que dentro de un mismo nivel energético existían subniveles.
- Es un modelo percusor del actual.
- El átomo de hidrógeno tiene un núcleo con un protón
- El átomo de hidrógeno tiene un electrón que está girando en la primera órbita alrededor del núcleo. Esta órbita es la de menor energía.
- Si se le comunica energía a este electrón, saltará desde la primera órbita a otra de mayor energía. Cuando regrese a la primera órbita emitirá energía en forma de radiación luminosa.
MODELO ACTUAL

El modelo atómico actual fue desarrollado en la década de 1920 por Schrödinger y Heisenberg. En este modelo las órbitas de los electrones del modelo de Bohr-Sommerfeld son sustituidas por los orbitales. Un orbital es una región del espacio en la que la probabilidad de encontrar al electrón es máxima. Los orbitales atómicos tienen distintas formas geométricas.
En el primer subnivel (s) sólo hay un orbital; en el segundo subnivel (p) hay tres orbitales; en el tercer subnivel (d) hay cinco orbitales y en el cuarto subnivel (f) hay siete orbitales.
En cada orbital puede haber como máximo dos electrones.
Los orbitales atómicos tienen distintas formas geométricas.


Está claro que la física es mucho mejor que la química. Más relevante en la historia de la humanidad y más divertida. Queda dicho. #JuanMandaYNoTuBanda #NoeliaNiTeRayesQueTambiénNosGustaLaQuímica #MaríaEstáEnLaParra #TodoConAmorDelBuenoYDelSano #RutherfordElAmoDeSuBarrio
ResponderEliminarQué hace un electrón cuando vomita?
ResponderEliminarBoooooooohr
Chicos, está súper bien, si fuera vuestro profesor de ampliación de física y química os pondría un 10...
ResponderEliminar